इस पेज पर आप कार्बन की परिभाषा, कार्बनिक यौगिकों का वर्गीकरण, गुण और उपयोग की समस्त जानकारी पढेंगे। यदि आप कार्बन की जानकारी जानना चाहते हैं तो आपको इस आर्टिकल को पूरा पढ़ना चाहिए।
पिछले पेज पर हमने सोडियम की जानकारी शेयर की हैं यदि आप सोडियम के बारे में जानना चाहते हैं तो उस पोस्ट को भी पढ़े।
चलिए आज हम कार्बन की परिभाषा, कार्बनिक यौगिकों का वर्गीकरण, गुण और उपयोग की समस्त जानकारी पढ़ते हैं।
कार्बन की परिभाषा
कार्बन एक अत्यधिक प्रतिक्रियाशील तत्व है। यह विभिन्न अन्य तत्वों के साथ बड़ी संख्या में यौगिक बनाता है। कार्बन शब्द लैटिन भाषा के ‘कार्बो’ शब्द से बना है जिसका अर्थ चारकोल होता है।
कार्बन पूरे ब्रह्मांड में चौथा सबसे प्रचुर मात्रा में पाया जाने वाला तत्व है। हमारे शरीर में यह ऑक्सीजन के बाद दूसरा सबसे प्रचुर तत्व है।
वास्तव में, इस दुनिया के सभी कार्बनिक पदार्थों में एक या अधिक रूपों में कार्बन होता है। यही कारण है कि कार्बन संपूर्ण कार्बनिक रसायन का आधार है।
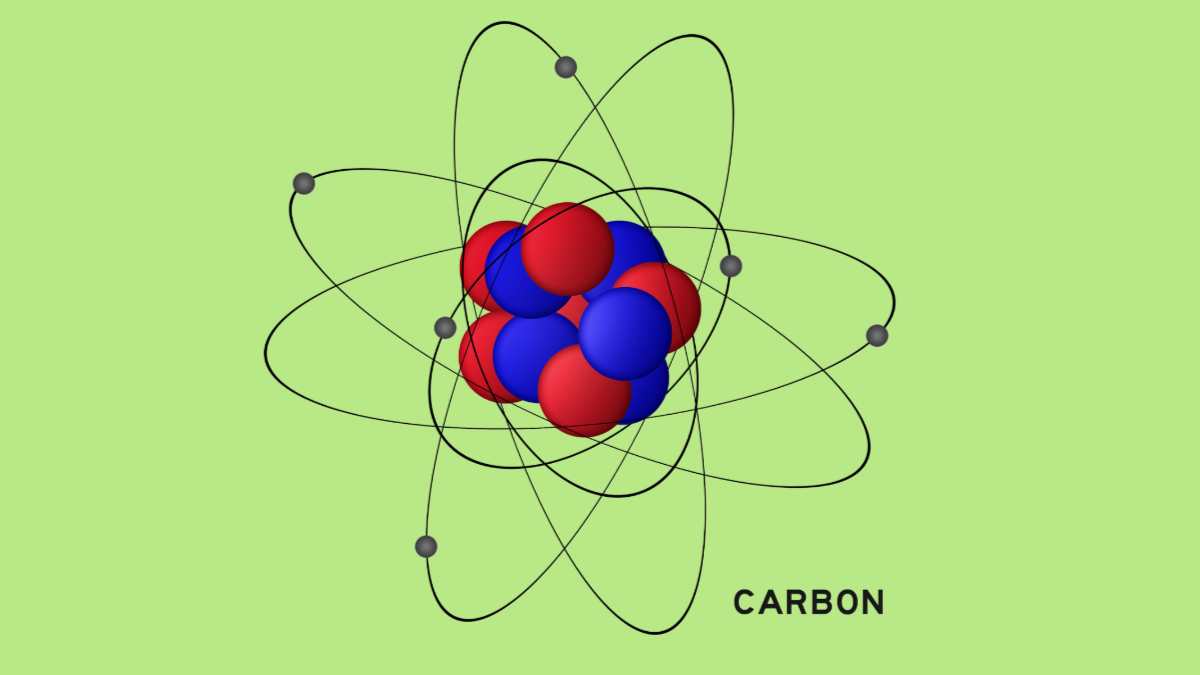
कार्बन एक अधातु तत्व है, जो आवर्त सारणी के समूह 14 में होता है और इसे C द्वारा दर्शाया गया है। इसकी परमाणु संख्या 6 होती है। इसलिए इसमें 6 प्रोटॉन, 6 इलेक्ट्रॉन और 6 न्यूट्रॉन होते हैं।
कार्बन अन्य कार्बन परमाणुओं के साथ कई तरह से जुड़ सकता है। यह आकार में भी छोटा होता है, इसलिए यह बड़े अणुओं में आसानी से समा जाता है। कार्बन ज्यादातर कोयले के भंडार में पाया जाता है।
कार्बन युक्त यौगिक कार्बनिक यौगिक कहलाते हैं। कार्बन द्वारा निर्मित सबसे सामान्य यौगिक मीथेन (CH₄) है।
कार्बन के अपरूप
कार्बन के विभिन्न रूपों को जिनके रासायनिक गुण एकसमान होते हैं लेकिन उनके भौतिक गुणों में अंतर रहता है, उन्हें कार्बन के अपरूप कहते हैं।
1. हीरा :- हीरा कार्बन का क्रिस्टलीय अपरूप है। इसका प्राकृतिक स्रोत किंबरलाइट पत्थर होता है। इसका आपेक्षिक घनत्व 3.52 होता है। हीरा ताप और विद्युत का कुचालक होता है।
2. ग्रेफाइट :- ग्रेफाइट भी कार्बन का एक अत्यंत ही उपयोगी क्रिस्टलीय अपरूप है। ग्रेफाइट की संरचना षट् कोणीय जालक सतह के रूप में होती है। ग्रेफाइट विद्युत का सुचालक होता है।
3. चारकोल :- यह कार्बन का अशुद्ध रूप है। यह कई प्रकार का होता है, जैसे काष्ठ चारकोल, अस्थि चारकोल, चीनी चारकोल और रक्त चारकोल।
4. काजल :- काजल कार्बन युक्त पदार्थों को हवा की अपर्याप्त मात्रा में जलाकर प्राप्त किया जाता है। इसमें लगभग 95% कार्बन मौजूद होता है।
5. कोयला :- कोयला मुख्यतः कार्बन के यौगिकों का मुक्त कार्बन का मिश्रण है। यह ऊर्जा का नवीकरणीय स्रोत है।
कार्बन यौगिकों में बंधन
कार्बन यौगिकों में कार्बन परमाणुओं के बीच बनने वाला बंधन सिंगल, डबल या ट्रिपल हो सकता है।
कार्बन परमाणुओं के बीच बनने वाले बंधनों की संख्या के आधार पर इन्हें दो भागों में बांटा गया हैं।
- संतृप्त कार्बन यौगिक
- असंतृप्त कार्बन यौगिक
1. संतृप्त कार्बन यौगिक
इन कार्बन यौगिकों में कार्बन परमाणु एक-दूसरे के साथ एकल बंधों द्वारा बंधे होते हैं। संतृप्त कार्बन यौगिकों का सबसे आम उदाहरण एल्केन हैं।
उदाहरण के लिए :- एथेन (C 2 H 6 ), एक अल्केन हैं, जो एक संतृप्त कार्बन यौगिक है।
2. असंतृप्त कार्बन यौगिक
इन कार्बन यौगिकों में कार्बन परमाणु एक-दूसरे के साथ डबल या ट्रिपल बॉन्ड द्वारा बंधे होते हैं।
असंतृप्त कार्बन यौगिकों के उदाहरण एल्कीन और एल्काइन हैं। ऐल्कीन में कार्बन का डबल बंध होता है, जबकि ऐल्काइन में त्रिबंध होता है।
उदाहरण :- एथीन (C₂H₄) और एथाइन (C₂H₂)
कार्बनिक यौगिकों का वर्गीकरण
कार्बनिक यौगिकों को दो मुख्य भागों में बांटा जा सकता है।
- ऐलिफेटिक या खुली श्रृंखला वाले यौगिक
- बंद श्रृंखला वाले या चक्रीय यौगिक
1. ऐलिफेटिक या खुली श्रृंखला वाले यौगिक
वैसे कार्बनिक यौगिक जिनमें कार्बन के सभी परमाणु एक खुली श्रृंखला में जुड़े रहते हैं, ऐलिफेटिक यौगिक कहलाते हैं। इनमें कार्बन परमाणु सीधी या शाखित श्रृंखलाओं में जुड़ते हैं।
उदाहरण के लिए ब्यूटेन सरल श्रृंखला वाले यौगिक है।
CH₃ − CH₂ − CH₂ − CH₃
2. बंद श्रृंखला वाले या चक्रीय यौगिक
वैसे यौगिक जिनमें कार्बन परस्पर संयुक्त होकर एक बंद श्रृंखला या चक्र बनाते हैं, बंद श्रृंखला वाले या चक्रीय यौगिक कहलाते हैं।
जैसे :- बेंजीन
कार्बन और इसके यौगिकों के भौतिक गुण
कार्बन और इसके यौगिक के भौतिक गुण निम्नलिखित हैं।
- कार्बन यौगिकों का क्वथनांक और गलनांक कम होता है।
- कार्बनिक यौगिक अधिकतर बिजली के कुचालक होते हैं क्योंकि उनमें मुक्त इलेक्ट्रॉनों और आयनों की कमी होती है। अपवाद :- ग्रेफाइट
- कार्बन ग्रे या काले रंग का होता है।
- कार्बन का परमाणु द्रव्यमान 12.011 g.mol – 1 तथा विद्युत ऋणात्मकता 2.5 होती है।
- कार्बन का गलनांक और क्वथनांक क्रमशः 3652 °C और 4827 °C होता है।
कार्बन यौगिकों के रासायनिक गुण
कार्बनिक यौगिक के रासायनिक गुण निम्नलिखित हैं।
1. दहन
जब कार्बनिक यौगिको का ऑक्सीजन की उपस्थिति में दहन होता हैं तो कार्बन डाइऑक्साइड, जल, गर्मी और प्रकाश उत्पन्न होता हैं।
2. ऑक्सीकरण
कार्बनिक यौगिक ऑक्सीजन की उपस्थिति में ऑक्सीकृत हो जाते हैं। उदाहरण के लिए, कार्बन का जब ऑक्सीकरण किया जाता हैं तो वह कार्बन मोनोऑक्साइड मे बदल जाता हैं।
3. रसायनिक बंधन
कार्बन में परमाणुओं की सीधी या श्रृंखला बनाने की क्षमता होती है।
उदाहरण :- जब एथीन को (जिसमें दोहरा बंधन होता है) हाइड्रोजन की उपस्थिति में निकल उत्प्रेरक का उपयोग करके गर्म किया जाता है, तो यह ईथेन का उत्पादन करता है।
4. प्रतिस्थापन प्रतिक्रिया
प्रतिस्थापन प्रतिक्रिया एक ऐसी प्रतिक्रिया है जिसमें एक यौगिक में एक कार्यात्मक समूह को दूसरे कार्यात्मक समूह द्वारा प्रतिस्थापित किया जाता है।
कार्बन का उपयोग
हमारे दैनिक जीवन में कार्बन का व्यापक रूप से उपयोग किया जाता है, जो निम्नलिखित हैं।
- मानव शरीर का 18% हिस्सा कार्बन से बना है। उदाहरण के लिए, चीनी, ग्लूकोज और प्रोटीन सभी में कार्बन होता है। हमारे शरीर को ऊर्जा प्रदान करने वाले कार्बोहाइड्रेट में कार्बन भी होता है, जैसे, ग्लूकोज, फ्रुक्टोज, सुक्रोज आदि।
- हीरा, कार्बन का एक रूप है। इसका व्यापक रूप से गहने बनाने में उपयोग किया जाता है। इसके अलावा यह सबसे कठोर पदार्थ है, इसलिए इसका उपयोग कठोर वस्तु को काटने और अन्य उद्देश्यों के लिए भी किया जाता है।
- कार्बन का उपयोग स्याही और पेंट बनाने में और बैटरी में भी किया जाता है।
- ग्रेफाइट, कार्बन का एक रूप है। जिसका पेंसिल में प्रयोग किया जाता है। इसका उपयोग स्टील के उत्पादन में भी किया जाता है।
- कार्बन का उपयोग कार्बन डेटिंग में भी किया जाता है जिसमें इसका उपयोग जीवाश्मों और अन्य निर्जीव चीजों की आयु मापने के लिए किया जाता है।
उम्मीद हैं आपको कार्बन की परिभाषा, कार्बनिक यौगिकों का वर्गीकरण, गुण और उपयोग की जानकारी पसंद आयी होगी। यदि आपको यह पोस्ट पसंद आयी हो तो अपने दोस्तों के साथ जरूर शेयर करें।